6月13日,默沙东(MSD)宣布其明星产品PD-1抑制剂帕博利珠单抗(商品名:可瑞达®)已正式获得中国国家药品监督管理局(NMPA)的批准,与仑伐替尼联合经动脉化疗栓塞(TACE),用于治疗不可切除的非转移性肝细胞癌患者。这一里程碑式的进展,不仅为肝癌患者带来了新的治疗选择,也标志着我国肝癌治疗领域迈入了一个全新的阶段。
肝癌,作为中国第四大高发和第二大死亡癌种,其治疗难度之大、预后之差,一直是医学界亟待攻克的难题。据摩熵医药数据显示,2022年中国肝癌新发病例高达36.77万,死亡病例达31.65万,更为严峻的是,肝癌预后极差,发病率与死亡率之比达到1:0.9。
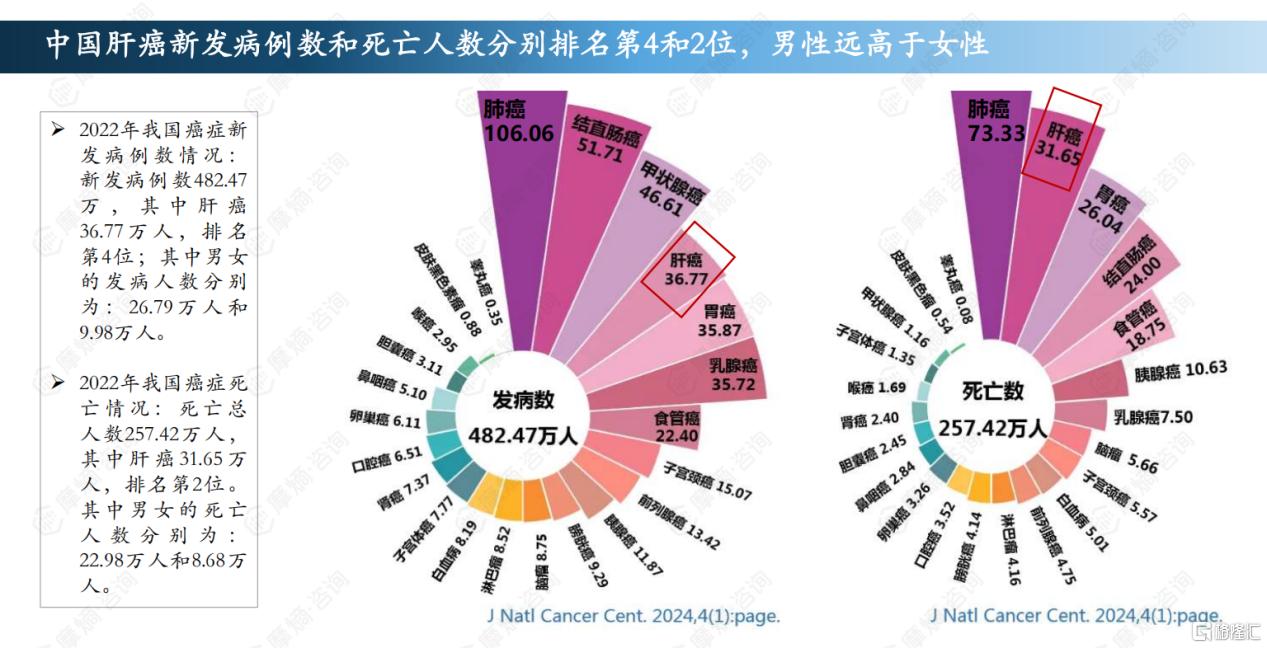
截图来源:摩熵咨询《肝癌药物——市场研究专题报告》
在此背景下,默沙东公司凭借其深厚的研发实力和前瞻性的战略布局,成功推出了帕博利珠单抗与仑伐替尼联合TACE的创新治疗方案。这一方案的获批,是基于III期临床试验LEAP-012研究的积极数据。该研究纳入了全球33个国家的480例Child-Pugh A级肝癌患者,结果显示,相比于使用TACE+双联安慰剂的患者,采用TACE+帕博利珠单抗+仑伐替尼方案的患者,无进展生存期显著延长至14.6个月,疾病进展和死亡风险降低了34%;24个月总生存率提升至75%,死亡风险降低了20%。
帕博利珠单抗作为PD-1抑制剂的佼佼者,通过阻断PD-1/PD-L1信号通路,恢复T细胞的免疫功能,从而杀伤肿瘤细胞。据摩熵医药数据库显示,帕博利珠单抗近几年在全国医院(全终端)的销售额一直保持着增长态势,市场潜力也在持续攀升中。此前(6月7日),默沙东也递交了 PD-1 抑制剂帕博利珠单抗注射液(皮下注射)的上市申请,并成功获得受理。(点击跳转阅读原文:300亿药王,国内首款K药皮下注射版申报上市!)
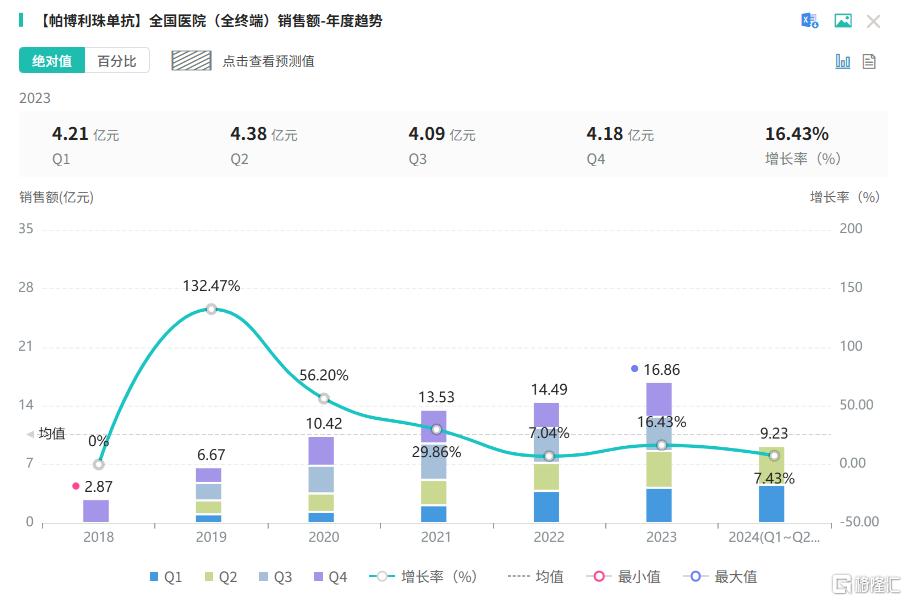
截图来源:摩熵医药全国医院(全终端)销售数据库
仑伐替尼(lenvatinib)是一种口服多种激酶抑制剂,可以选择性抑制多种激酶的活性,包括血管内皮生长因子受体(VEGFR1、VEGFR2和VEGFR3),以及成纤维细胞生长因子受体(FGFR1、FGFR2、FGFR3和FGFR4),此外还有致病性血管生成、肿瘤生长和癌症进展相关受体酪氨酸激酶,如血小板衍生生长因子受体α(PDGFRα)、KIT和RET。该药由卫材药业研发,2018年获FDA批准用于晚期HCC系统治疗,是继索拉非尼之后十多年来首次获批用于晚期HCC一线治疗的新药,同年也在中国获批上市。
仑伐替尼作为单药,已经在日本、美国、欧洲、中国等国家和地区获批用于一线治疗甲状腺癌和肝细胞癌,仑伐替尼与抗PD-1单抗帕博利珠单抗组成的联合疗法也已经在多地获批用于一线治疗肾细胞癌、既往经过全身治疗的子宫内膜癌等。
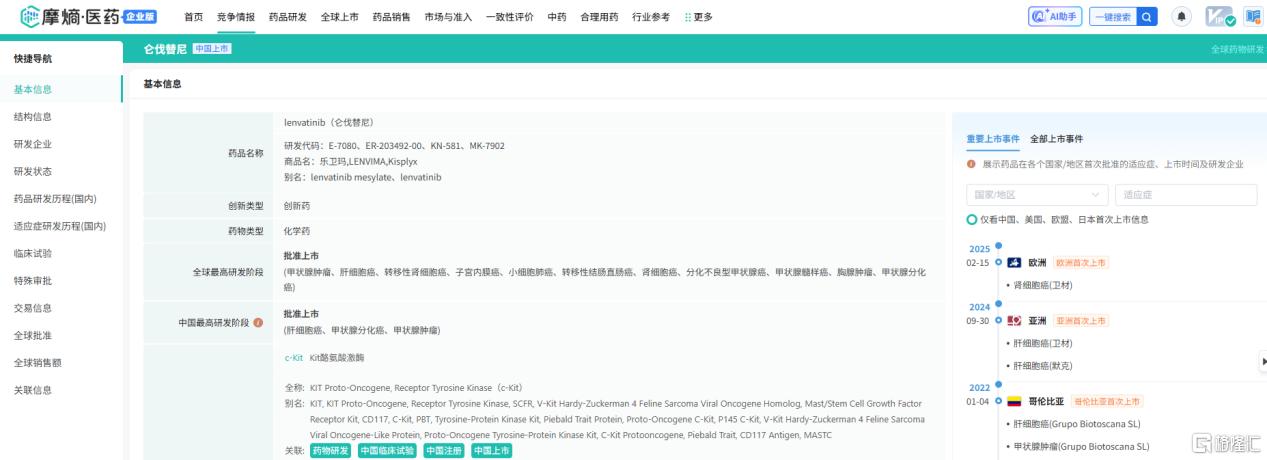
截图来源:摩熵医药全球药物研发数据库
仑伐替尼作为一种多靶点酪氨酸激酶抑制剂,能够抑制肿瘤血管生成和肿瘤细胞增殖。两者联合TACE,形成了优势互补、协同增效的治疗模式,为肝癌患者带来了新希望。
在安全性方面,虽然TACE+仑伐替尼+帕博利珠单抗组和TACE+双联安慰剂组分别有71%和76%的患者发生3级及以上不良事件,但大多数不良事件均可通过有效的管理和支持治疗得到控制。这一方案不仅延长了患者生存期,也可以提升患者的生活质量。
LEAP-012研究的主要研究者、复旦大学附属中山医院肝胆肿瘤内科主任医师任正刚教授表示:“我国大多数的肝细胞癌患者初诊时已经失去手术治疗机会,此次帕博利珠单抗与仑伐替尼联合TACE新适应症的获批,为对抗肝细胞癌这一难治癌种提供了又一新方案,也为患者带来了新的治疗选择与希望。”
默沙东全球高级副总裁、默沙东中国研发中心总裁李正卿也强调:“默沙东始终积极探寻能够改变癌症治疗的方式与可能,向前探索科学的边界。此次联合用药获批是基于国际多中心临床试验LEAP-012研究数据,其中入组中国患者占比43.3%,这也是该适应症的全球首次获批,将为中国肝细胞癌的临床治疗带来新的选择。”
结语
随着帕博利珠单抗与仑伐替尼联合TACE方案的获批,肝癌治疗领域迎来了新的曙光。这一创新联合方案不仅为患者提供了更为有效的治疗手段,也为临床医生提供了更多的治疗选择。未来,随着研究的不断深入和临床应用的不断拓展,我们有理由相信,肝癌的治疗效果将得到进一步提升,更多患者将从中受益。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员




