在全球化浪潮奔涌的当下,中国医药企业正以铿锵步伐迈向国际舞台,新兴市场如东南亚、中东、非洲及“一带一路”沿线国家,凭借超40亿人口基数、年均12%的医疗需求增长及政策东风,成为药企全球化征程中的战略要地。然而,复杂的注册法规、多元的临床要求、激烈的国际竞争,让众多企业在出海之路上遭遇“出海难、落地难”的困境,如何在这片充满机遇与挑战的蓝海破浪前行,成为行业共同关注的焦点。

2025年6月12日,摩熵数科将在江苏南京举行熵创会的“破局增量・全渠道营销”线下会议,此次会议恰逢其时,将联合政策专家、头部药企营销总监与数智化先锋,聚焦院内、院外、医药数智化转型三大核心命题,为中国医药企业破解出海难题、开启海外营销新路径提供智慧碰撞的平台。
在这样的背景下,深入剖析新兴市场出海的机遇与挑战,探讨不同产品类型的注册及临床策略,对于企业在全球化浪潮中找准定位、强化创新、布局差异化战略,进而实现合规、高效、可持续的全球化发展,具有尤为重要的现实意义。
一、新兴市场出海的机遇与挑战
巨大市场潜力:全球医药市场规模呈现稳步增长态势。据摩熵医药数据分析,2024年全球医药市场规模约1.66万亿美元,预计至2030年将增长至2.11万亿美元,年复合增长率预计在2024~2030年将达4.03%。全球医药市场的持续增长,为我国药企出海提供了广阔的市场空间。
创新能力趋于成熟:我国本土药企的创新能力逐渐成熟,获批创新药数量增加显著。根据摩熵医药数据统计,自2018年起我国国产创新药获批临床数量(按受理号计)显著增长,其中2021、2022年获批数量分别达1292、1157件并于2023年达历史新高1687件。在获批上市方面,2020年获批创新药数量最多,国产达到47款,进口5款;整体来看,国产获批数量显著多于进口数量。
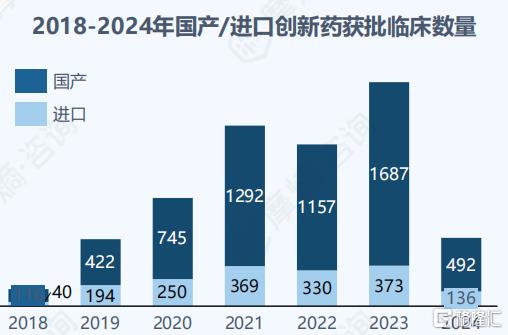
图片来源:摩熵咨询《跨越国界,引领创新——中国药企出海的布局实践》
竞争日益激烈:随着越来越多药企出海,新兴市场竞争加剧。企业需要在产品质量、价格、注册申报效率等方面不断提升竞争力,才能在市场中占据一席之地。比如,印度等国家在仿制药领域积累了丰富经验,中国药企可以借鉴其在语言、政策和合规方面的优势,结合自身强大制造能力与供应链优势,进一步拓展市场份额。
二、不同产品类型的注册及临床策略
1. 创新药:欧美布局为锚,辐射全球市场
美国FDA作为全球监管标杆,其认可的临床数据可加速渗透90%以上新兴市场。因此布局欧美是常见策略,通过在美国开展临床试验、国际多中心临床、非美国临床+美国桥接试验等方式,满足FDA审评要求,进而辐射全球市场。
药企可根据研发进度选择四种临床路径:
本土直入(美国直接开临床):适合资金充足的First-in-Class药物,需匹配本地CRO(如IQVIA、PRAHealth)确保合规性;
国际多中心(含美国中心):性价比之选,需提前与FDA沟通种族敏感性分析(如中国患者占比≤30%时需分层统计),典型案例:百济神州PD-1单抗全球Ⅲ期试验覆盖15国,加速欧美同步获批;
桥接试验(非美数据+美国补充):适用于孤儿药/突破性疗法,如传奇生物CAR-T疗法以中国数据为基础,仅补充50例美国患者即获FDA批准;
单一区域数据:高风险策略,仅适用于临床设计高度严谨的罕见病药物(如诺华Zolgensma以欧盟数据申报FDA)。
2.化学仿制药:剂型差异决定注册路径
无需重复大量临床试验,但不同类型要求不同。高复杂性注射剂可能需额外体外生物等效性和PK研究;口服化学仿制药BE要求较严苛,且不同地区对BE试验机构和参比药物要求不同,企业需提前了解并准备。
高复杂制剂(微球/脂质体):FDA/EMA要求额外体外BE与PK研究,如绿叶制药利培酮微球通过对比原研药释药曲线(相似度≥90%)突破欧美壁垒;
普通注射剂:东南亚(新马泰)接受FDA/EMA批准文件,无需本地BE,但需提供辅料相容性报告(如聚山梨酯80的欧洲药典认证);
口服固体制剂:欧美要求BE机构通过FDA现场检查(中国仅23家机构获认),中东沙特需附加种族药代动力学分析(如CYP450酶基因型差异)。
3.生物类似物:头对头试验为核心,区域监管有侧重
在欧美市场需进行头对头临床试验,证明与原研药相似性,且欧美监管要求略有差异。其他区域准入相对宽松,若获得欧美认证,其他地区准入更顺利。
欧美市场:EMA强制要求Ⅲ期头对头试验(如复宏汉霖曲妥珠单抗对比罗氏原研药,ORR差异<5%),FDA允许外推适应症时仅需药效学数据;
新兴市场:东南亚/中东接受FDA/EMA批准文件,未获认证则需桥接试验(如在印尼补充200例患者免疫原性检测),非洲国家普遍要求本地伦理委员会审批+至少50例安全性随访。
三、强化创新·破局增量·布局差异化
2025年6月12日,摩熵数科将在江苏南京举行熵创会的“破局增量·全渠道营销”线下会议,联合政策专家、头部药企营销总监与数智化先锋,聚焦院内、院外、医药数智化转型三大核心命题。如何跨越壁垒,让中国医药企业开启海外营销新路径?国药集团投资总监将进行实战案例分享,期待与您一同探讨企业合规、高效、可持续的全球化营销战略。
熵创会“破局增量·全渠道营销”线下会议亮点:
直面真问题:拒绝空谈概念,所有议题源于药企调研的共性痛点;
方法论沉淀:汇聚了国内头部药企中高层、高校研究中心、头部平台企业等相关核心成员;
资源精准对接:参会人群包括医药代理商500人+,制药工业企业50家+,医药供应链服务类企业20家+,破解资源错配难题;
专著及报告领取:现场参会可领取88份深度咨询报告、《全球重磅药物成功启示录》等重磅资料。

 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员




